Views: 18
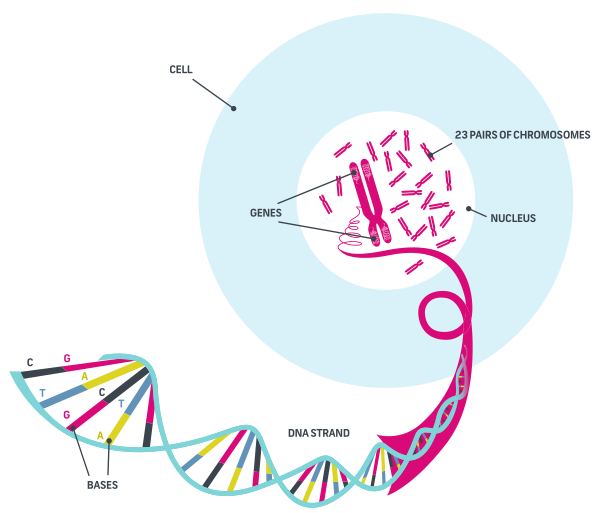 Gli organismi monocellulari come i batteri, contrariamente a come spesso si crede, hanno una unica mission: quella di riprodursi.
Gli organismi monocellulari come i batteri, contrariamente a come spesso si crede, hanno una unica mission: quella di riprodursi.
Non producono le malattie perché ci vogliono male! Diventano patogeni in particolari condizioni, mentre in altre spesso convivono con noi come saprofiti. Essi vivono la propria esistenza nel buio più totale, non essendo dotati di trasduttori che trasformano la radiazione luminosa in onde elettriche trasmesse ad un sistema nervoso centrale che non possiedono. E per la stessa ragione passano le loro giornate nel silenzio più profondo non possedendo dispositivi in grado di trasformare le onde sonore trasmesse dall’aria in segnali elettrici captabili da un cervello che non hanno. Infine rappresentano solo una trasmissione genotipica, non posseggono cioè la possibilità di espressioni fenotipiche. I batteri quindi, al contrario degli organismi multicellulari, hanno, in un certo senso, il dono dell’immortalità, poiché per moltiplicarsi dividono se stessi in due entità uguali alla cellula originaria. Si possono potenzialmente replicare un numero infinito di volte. La loro unicellularità, inoltre, li esenta dalle malattie tumorali. Infatti, il cancro, a ben pensarci, è una malattia dell’organismo pluricellulare le cui cellule presentano modalità di organizzazione diverse all’interno dello steso organismo. 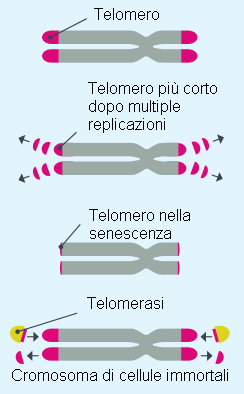 Le cellule eucariote si dividono un numero programmato di volte, ma poi, alla data riportata nel loro codice genetico, arriva la morte cellulare programmata, ovvero l’apoptosi. Se esistono meccanismi di compenso e di rimpiazzo (come le cellule staminali) attivi e funzionanti, la vita procede, altrimenti si realizza la morte dell’organismo.
Le cellule eucariote si dividono un numero programmato di volte, ma poi, alla data riportata nel loro codice genetico, arriva la morte cellulare programmata, ovvero l’apoptosi. Se esistono meccanismi di compenso e di rimpiazzo (come le cellule staminali) attivi e funzionanti, la vita procede, altrimenti si realizza la morte dell’organismo.
L’apoptosi rappresenta quindi un millenario contratto scritto nel codice genetico che regola la corretta relazione delle cellule nei confronti dell’organismo nel suo complesso. Ma come succede spesso nei rapporti interpersonali della società degli uomini, si corre il rischio che qualcuno imbrogli, mettendo in discussione le regole del contratto riportate nel codice genetico. Infatti, come per gli uomini a volte qualcuno tenta di beneficiare dei vantaggi del vivere sociale senza sottostare alle regole dettate dalla civile coesistenza. Ad esempio c’è chi evita di pagare le tasse o chi non rispetta le aree di parcheggio riservate ai diversamente abili o ancora chi salta la fila dal panettiere. Ecco che se non vengono rispettate le regole dell’apoptosi si realizza la proliferazione incontrollata di una linea cellulare a discapito delle altre e quindi il cancro. Un fenomeno biologico figlio di una infrazione delle regole dell’organismo che affonda le proprie radici evolutive nell’origine della vita sulla terra.
In condizioni normali si osserva, via via che la cellula si riproduce, una progressiva riduzione dei telomeri: quella estremità del cromosoma che sovrintende al controllo della normale replicazione del DNA (componente fondamentale del cromosoma stesso). Nel corso delle replicazioni il telomero si accorcia fino a raggiungere una lunghezza che non consente la replicazione cellulare e quindi la linea cellulare invecchia fino all’estinzione. In alcuni casi l’enzima telomerasi ripristina la lunghezza dei telomeri alle estremità dei cromosomi garantendo la replicazione cellulare incontrollata.
In una ricerca pubblicata su Science del 12 aprile 2019 sono riportati i dati ottenuti dallo studio di due gemelli monocoriali: uno rimasto in orbita sulla Stazione Spaziale Internazionale (ISS) per un anno e l’altro sulla terra. L’evoluzione della specie ha preparato l’uomo, nel corso di centinaia di migliaia di anni, a sopravvivere nelle condizioni più proibitive ed estreme offerte dal nostro pianeta, ma sempre in condizioni di omeostasi garantite per esempio dalla presenza dell’atmosfera o dalla forza di gravità. Lo studio ha dimostrato che la lunga permanenza nello spazio determina delle modificazioni (adattamenti?) che sembrano regredire senza significativi reliquati una volta rientrati sulla terra.
La lunga permanenza nello spazio a 450 chilometri dalla superficie della terra ha prodotto un allungamento dei telomeri con conseguente maggiore esposizione al rischio tumorale che nel fratello rimasto sulla terra non è stato osservato. Una delle probabili spiegazioni è che le modifiche telomeriche osservate rappresentino la capacità dell’organismo umano di potersi adattare a condizioni ambientali diverse. Non è chiaro però se si tratti di cambiamenti positivi o negativi e soprattutto l’evoluzione di tali mutamenti e la loro eventuale correlazione con la genesi tumorale.
Nella nostra quotidianità siamo esposti a sostanze o processi oncogenetici che possono produrre errori di replicazione del DNA cellulare (per fattori esogeni quale il fumo o per fattori endogeni quali l’ereditarietà) che vengono riconosciuti dal sistema immunitario, nel suo vasto programma definito di “sorveglianza immunitaria”. Questa nella gran parte dei casi procede a disinnescare la cellula patologica che potrebbe portare allo sviluppo del cancro. Il problema nasce non appena queste modificazioni in senso oncogenetico sfuggono alla sorveglianza e producono la malattia tumorale che si sviluppa nell’individuo.
Bibliografia
1) L. Mirabello, W.Y. Huang, J.Y. Wong, N. Chatterjee, D. Reding, E.D. Crawford, I. De Vivo, R.B. Hayes, S.A. Savage. The association between leukocyte telomere length and cigarette smoking, dietary and physical variables, and risk of prostate cancer. Aging Cell. 2009;8:405–413.
2) J.H. Barrett, M.M. Iles, A.M. Dunning, K.A. Pooley. Telomere length and common disease: study design and analytical challenges. Hum Genet. 2015;134:679–689.
3) A. Zietzer, P. Hillmeister. Leucocyte telomere length as marker for cardiovascular ageing. Acta Physiol (Oxf) 2014;211:251–256.
4) G. Saretzki. Telomerase, mitochondria and oxidative stress. Exp Gerontol. 2009;44:485–492.
5) R. M. Cawthon, Telomere length measurement by a novel monochrome multiplex quantitative PCR method. Nucleic Acids Res. 37, e21 (2009). doi: 10.1093/nar/gkn1027; pmid: 19129229
6) B. J. Sishc et al., Telomeres and telomerase in the radiation response: Implications for instability, reprograming, and carcinogenesis. Front. Oncol. 5, 257 (2015). doi: 10.3389/fonc.2015.00257; pmid: 26636039
7) J. Lin et al., Systematic and cell type-specific telomere length changes in subsets of lymphocytes. J. Immunol. Res. 2016, 5371050 (2016). doi: 10.1155/2016/5371050; pmid: 26977417 23. P. M. Lansdorp et al., Heterogeneity in telomere length of human chromosomes. Hum. Mol. Genet. 5, 685–691 (1996). doi: 10.1093/hmg/5.5.685; pmid: 8733138
8) 24. B. J. Sishc et al., Telomeres and telomerase in the radiation response: Implications for instability, reprograming, and carcinogenesis. Front. Oncol. 5, 257 (2015). doi: 10.3389/fonc.2015.00257; pmid: 26636039
9) 25. C. W. Greider, E. H. Blackburn, Identification of a specific telomere terminal transferase activity in Tetrahymena extracts. Cell 43, 405–413 (1985). doi: 10.1016/0092-8674(85)90170-9; pmid: 3907856
10)26. M. Hou, D. Xu, M. Björkholm, A. Gruber, Real-time quantitative telomeric repeat amplification protocol assay for the detection of telomerase activity. Clin. Chem. 47, 519–524 (2001). pmid: 11238306
11)M. A. Shammas, Telomeres, lifestyle, cancer, and aging. Curr. Opin. Clin. Nutr. Metab. Care 14, 28–34 (2011). doi: 10.1097/MCO.0b013e32834121b1; pmid: 21102320
12)W. R. Pendergrass, P. E. Penn, J. Li, N. S. Wolf, Age-related telomere shortening occurs in lens epithelium from old rats and is slowed by caloric restriction. Exp. Eye Res. 73, 221–228 (2001). doi: 10.1006/exer.2001.1033; pmid: 11446772
13)M. Laimer et al., Telomere length increase after weight loss induced by bariatric surgery: Results from a 10 year prospective study. Int. J. Obes. 40, 773–778 (2016). doi: 10.1038/ijo.2015.238; pmid: 26607038
14)L. F. Cherkas et al., The association between physical activity in leisure time and leukocyte telomere length. Arch. Intern. Med. 168, 154–158 (2008). doi: 10.1001/archinternmed.2007.39; pmid: 18227361
15)L. Carulli et al., Telomere length elongation after weight loss intervention in obese adults. Mol. Genet. Metab. 118, 138–142 (2016). doi: 10.1016/j.ymgme.2016.04.003; pmid: 27157420
16)V. Boccardi, G. Paolisso, P. Mecocci, Nutrition and lifestyle in healthy aging: The telomerase challenge. Aging 8, 12–15 (2016). doi: 10.18632/aging.100886; pmid: 26826704
17)N. C. Arsenis, T. You, E. F. Ogawa, G. M. Tinsley, L. Zuo, Physical activity and telomere length: Impact of aging and potential mechanisms of action. Oncotarget 8, 45008–45019 (2017). doi: 10.18632/oncotarget.16726; pmid: 28410238.
18)J. Zhang et al., Ageing and the telomere connection: An intimate relationship with inflammation. Ageing Res. Rev. 25, 55–69 (2016). doi: 10.1016/j.arr.2015.11.006; pmid: 26616852 69. R. C. Stone et al., Telomere length and the cancer/atherosclerosis trade-off. PLOS Genet. 12, e1006144 (2016). doi: 10.1371/journal.pgen.1006144; pmid: 27386863
19)F. Berardinelli et al., The role of telomere length modulation in delayed chromosome instability induced by ionizing radiation in human primary fibroblasts. Environ. Mol. Mutagen. 54,172–179 (2013). doi: 10.1002/em.21761; pmid: 23401031
20)Terry, D.F., Nolan, V.G., Andersen, S.L., et al., “Association of Longer Telomeres With Better Health in Centenarians,” Journal of Gerontology: Biological Sciences, 63A(8): 809-812, 2008
21)Garrett-Bakelman et al., The NASA Twins Study: A multidimensional analysis of a year-long human spaceflight.: Science 364, 144 (2019)
22)L. Carulli et al., Telomere length elongation after weight loss intervention in obese adults. Mol. Genet. Metab. 118, 138–142(2016).
23)F. Berardinelli et al., The role of telomere length modulation in delayed chromosome instability induced by ionizing radiation in human primary fibroblasts. Environ. Mol. Mutagen. 54,172–179 (2013).
24)J. Zhang et al., Ageing and the telomere connection: An intimate relationship with inflammation. Ageing Res. Rev. 25,55–69 (2016).
25)R. C. Stone et al., Telomere length and the cancer-atherosclerosis trade-off. PLOS Genet. 12, e1006144 (2016)
26)N. C. Arsenis, T. You, E. F. Ogawa, G. M. Tinsley, L. Zuo, Physical activity and telomere length: Impact of aging and potential mechanisms of action. Oncotarget 8, 45008–45019(2017).
27)M. A. Shammas, Telomeres, lifestyle, cancer, and aging. Curr. Opin. Clin. Nutr. Metab. Care 14, 28–34 (2011).