Views: 1
Raffaella Cresti, Rosa Draisci e Leonello Attias Centro Nazionale Sostanze Chimiche, Prodotti Cosmetici e Protezione del Consumatore, ISS
L’emergenza pandemica ha reso urgente l’utilizzo intensivo di prodotti per la disinfezione delle mani, in particolare negli ambienti sanitari dove gli operatori sono maggiormente esposti al rischio di infezione. I prodotti per la disinfezione sono immessi in commercio ai sensi del DPR n. 392/1998 sui Presidi Medico Chirurgici o del Regolamento (UE) n. 528/2012 sui biocidi. Per i prodotti biocidi il rilascio dell’autorizzazione alla commercializzazione è condizionato alla valutazione che ne dimostri l’efficacia e l’uso sicuro. Al fine di valutare l’esposizione ai prodotti biocidi per la disinfezione delle mani è stata sviluppata una metodologia, che combina diversi modelli sviluppati in ambito europeo con alcuni algoritmi e che delinea uno scenario di esposizione realistico. Parole chiave: biocidi; disinfettanti; valutazione dell’esposizione; esposizione professionale
L’emergenza sanitaria determinata dalla pandemia da SARS-CoV-2 ha reso più urgente e particolarmente intensivo l’uso di prodotti per la disinfezione delle mani, in particolare in ambito sanitario da parte degli operatori, allo scopo di limitare l’eventuale rischio di contagio. Dal punto di vista normativo i prodotti disinfettanti, la cui azione vantata in etichetta è di eliminare i microorganismi, sono immessi in commercio ai sensi del DPR 6 ottobre 1998, n. 392 sui Presidi Medico Chirurgici (PMC) (1) insieme al Provvedimento del 5 febbraio 1999 (2) o del Regolamento (UE) n. 528/2012 sui biocidi (Regolamento biocidi; Biocidal Products Regulation, BPR) (3). I PMC sono regolamentati dalla normativa nazionale e venduti solo dopo autorizzazione attraverso il rilascio di un numero di registrazione da parte del Ministero della Salute. Diversamente, i prodotti biocidi, contenenti principi attivi precedentemente approvati ai sensi del BPR per la specifica tipologia di prodotto, sono regolamentati a livello Comunitario e per la loro commercializzazione è prevista un’autorizzazione del Ministero della Salute o della Commissione Europea. L’autorizzazione ai sensi del BPR giunge al termine di un processo di valutazione che deve dimostrare non solo l’efficacia del prodotto in esame, ma anche il suo uso sicuro nelle condizioni di utilizzo autorizzate. Il Centro Nazionale Sostanze Chimiche, Prodotti Cosmetici e Protezione del Consumatore (CNSC, www.cnsc.iss.it) dell’Istituto Superiore di Sanità, ha fra i suoi compiti la valutazione di pericoli e rischi connessi all’uso di prodotti PMC/biocidi ed è stato coinvolto, sin dalla prima fase della pandemia da COVID-19, attraverso l’istituzione – tramite apposito Decreto n. 72/2020, del Gruppo di lavoro Biocidi
e procedure disinfezione COVID-19 (4) per fornire supporto a molteplici attori (autorità, organi di controllo, istituzioni pubbliche, federazioni e associazioni professionali) coinvolti nella gestione dell’emergenza, definire procedure di disinfezione/sanificazione di superfici e ambienti, e proseguire le attività di valutazione dei dossier presentati dalle imprese per l’autorizzazione dei PMC e dei biocidi da parte del Ministero della Salute e della Commissione Europea. In tale ambito, il CNSC partecipa alle attività del gruppo di esperti di esposizione umana, istituito nell’ambito dell’Agenzia Europea per le Sostanze Chimiche (European CHemical Agency, ECHA) per l’implementazione del Regolamento biocidi (HEAdhoc Working Group, di seguito riportato HEAdoc). All’interno dell’iter autorizzativo definito dal BPR, un ruolo rilevante è rappresentato dalla valutazione del rischio per la salute umana, nel cui contesto il Regolamento richiede, per ciascun prodotto autorizzato, lo sviluppo di scenari di esposizione che identificano le condizioni di uso sicuro e le eventuali misure di gestione del rischio stesso. Un passaggio critico è, quindi, rappresentato dalla definizione dello scenario di esposizione e delle condizioni che descrivono l’uso del prodotto da parte della popolazione potenzialmente esposta, rappresentata in questo caso dai lavoratori che operano in contesti sanitari, come gli ospedali (5). Definizione dello scenario di esposizione Allo scopo di effettuare la valutazione del rischio per l’autorizzazione dei prodotti disinfettanti per le mani a uso professionale negli ospedali, il gruppo di esperti di esposizione umana HEAdoc ha sviluppato un modello di esposizione che considera le reali condizioni di utilizzo del prodotto. L’HEAdoc ha elaborato due documenti tecnici specifici (denominati Recommendations), finalizzati a valutare lo scenario di esposizione dei prodotti disinfettanti per le mani utilizzati nel contesto sanitario. Le Recommendations forniscono ai valutatori utili strumenti, inclusi parametri e modelli di esposizione, da applicare nella valutazione al fine di garantire coerenza e armonizzazione nell’approccio seguito a livello Comunitario. In generale, i prodotti disinfettanti per le mani si suddividono in due categorie a seconda che la formulazione preveda o meno la presenza di principi attivi volatili. In particolare, i prodotti che contengono principi attivi volatili non richiedono, prevedibilmente, alcun risciacquo dopo l’applicazione (sono denominati disinfettanti senza risciacquo o hand rub products); al contrario, i prodotti con principi attivi non volatili (denominati disinfettanti con risciacquo o hand wash products) devono essere risciacquati dopo l’applicazione al fine di eliminare eventuali residui. Il primo documento Recommendation no. 1 (6), elaborato dall’HEAdhoc per le due diverse tipologie di prodotto, stabilisce i parametri relativi alla frequenza e alla durata del singolo evento, inteso come disinfezione delle mani. Entrambi i parametri, infatti, possono influenzare significativamente la stima finale dell’esposizione e la conseguente valutazione del rischio ed è pertanto necessario definirli in maniera univoca basandosi su dati scientifici, così da garantire che l’approccio nel processo di autorizzazione dei prodotti sia armonizzato da parte di tutti gli Stati Membri dell’Unione Europea. Il secondo documento Recommendation no. 9 (7) delinea le caratteristiche degli scenari di esposizione, incluse le condizioni di uso realistico, e individua il modello da utilizzare per stimare i livelli di esposizione attesi per le due tipologie di prodotto. Lo scenario di esposizione descrive le condizioni operative e le misure di gestione dei rischi, che devono essere adottate per controllare adeguatamente i rischi associati all’uso del prodotto. Il modello matematico parte da assunzioni che consentono di simulare condizioni di uso realistico del prodotto e, in assenza di dati di monitoraggio, consente di calcolare i livelli di concentrazione a cui è presumibilmente esposta la popolazione oggetto della valutazione. In particolare, lo scenario di esposizione definito per i disinfettanti per mani senza risciacquo applicati in ambiente ospedaliero assume che l’operatore sanitario (ad esempio, l’infermiere) sia responsabile di 8 pazienti, distribuiti in 4 camere da 2 posti letto ciascuna, che visita per 2 volte durante il proprio turno di lavoro. Nel visitare i pazienti all’interno di ogni camera, l’operatore sanitario effettua 3 disinfezioni delle mani (il modello assume che all’interno della camera l’operatore sanitario effettui una disinfezione delle mani prima di visitare ciascun paziente (per un totale di due disinfezioni) e una disinfezione al termine della seconda visita) a distanza di circa 10 minuti tra un’applicazione e l’altra e sostando nella camera per un tempo totale di 20 minuti. Pertanto, tenuto conto che l’operatore sanitario effettua la prima disinfezione delle mani a inizio turno, si prevede che al termine della giornata lavorativa abbia effettuato un totale di 25 disinfezioni delle mani (6). Il modello di esposizione per la stima quantitativa La presenza di principi attivi volatili all’interno dei prodotti disinfettanti per le mani senza risciacquo lascia intendere che il contributo prevalente all’esposizione sia dato dal rilascio delle sostanze (volatili) nell’aria circostante e che, pertanto, l’esposizione avvenga principalmente attraverso la loro inalazione. Il modello più affidabile per effettuare una stima realistica dell’esposizione attraverso la via inalatoria risulta essere il modello ConsExpo (sostituito, a partire dal 2016, da ConsExpo web (www.rivm.nl/en/consexpo) 4.1 con lo scenario Exposure to vapour: Constant rate release (7). Il modello ConsExpo è un sistema integrato di modelli matematici raccolti in un software e disponibile sul sito dell’Istituto Nazionale per la Salute Pubblica e l’Ambiente (Rijksinstituut voor Volksgezondheid en Milieu, RIVM) dei Paesi Bassi. Il modello, attraverso la definizione di diversi scenari, consente di stimare i livelli di esposizione attesi e associati all’uso di varie tipologie di prodotto destinate ai consumatori, tra cui i disinfettanti (8). Inoltre, per i principali parametri dell’esposizione il ConsExpo dispone di un’ampia banca dati con valori di default a cui attingere nel caso in cui non siano disponibili i valori reali relativi al prodotto esaminato (ad esempio, dettagli relativi alle circostanze in cui avviene l’esposizione alle sostanze contenute nel prodotto). Il modello ConsExpo, originariamente sviluppato per la valutazione di prodotti a uso domestico, per poter essere applicato in ambito occupazionale – come nel caso dei disinfettanti destinati agli operatori sanitari – ha richiesto l’elaborazione di un documento di orientamento a livello Comunitario. In particolare, il gruppo di esperti di esposizione umana coinvolti nella valutazione dei biocidi (Human Health Expert Group, HEEG, in seguito rinominato HEAdhoc Working Group) ha elaborato una linea guida che definisce i criteri per l’applicabilità del ConsExpo, sottolineando la necessità di modificare opportunamente i parametri di default, come ad esempio la frequenza e la durata dell’esposizione (9). Il modello selezionato per la valutazione dei prodotti disinfettanti per le mani senza risciacquo, Exposure to vapour: Constant rate release, consente di calcolare il livello di esposizione atteso dopo la prima applicazione assumendo che:
• la velocità di rilascio del prodotto dalla superficie su cui è stato applicato (ad esempio, la cute) e dall’ambiente sia costante nel tempo;
• la durata della prima esposizione sia di 10 minuti, pari al tempo intercorso tra un’applicazione e la successiva;
• la durata dell’emissione sia data dal tempo di evaporazione dalla cute, calcolato secondo un algoritmo (7). Gli altri parametri da inserire nel modello sono relativi alle dimensioni dell’ambiente in cui avviene l’esposizione (ad esempio, camera di 80 m3), al tasso di ricambio dell’aria (1,5 h-1) di questo ambiente e alla quantità di prodotto applicato (da 1 a 3 g). Quest’ultimo parametro, analogamente alla concentrazione di principio attivo presente nel prodotto, può variare in funzione delle informazioni fornite dal produttore che ha presentato la richiesta di autorizzazione del prodotto. Attraverso questi parametri, il modello ConsExpo calcola il livello di esposizione atteso dopo la prima applicazione di prodotto e delinea l’andamento decrescente nel tempo della concentrazione di principio attivo rilasciata nell’aria (Figura 1).
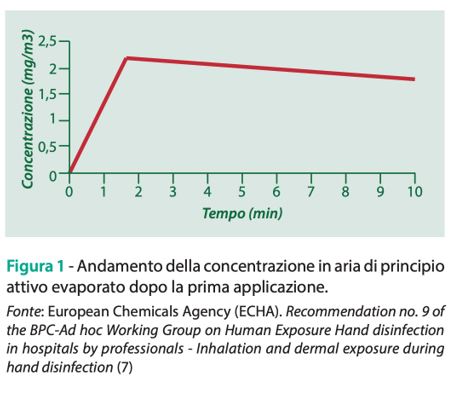
Ne consegue che il livello di esposizione atteso dopo la seconda applicazione del prodotto risulta incrementato dal contributo relativo alla concentrazione di sostanza residua che è stata rilasciata nell’ambiente durante la prima disinfezione (Figura 2).
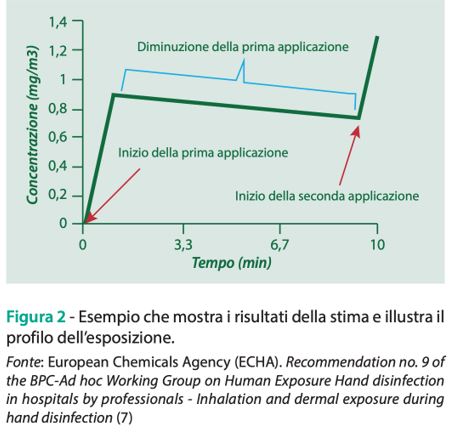
Considerazioni analoghe si applicano alla terza applicazione effettuata all’interno della stessa stanza. Pertanto, il principio generale è che il livello di esposizione calcolato per ogni singolo evento (successivo al primo) tiene conto anche del contributo dovuto alla presenza di una concentrazione residua derivante dalla/dalle applicazione/i precedente/i. Inoltre, come descritto dallo scenario di esposizione, al termine del primo giro di visite, dopo 240 minuti l’operatore sanitario ne effettua un secondo tornando nelle medesime camere dove la concentrazione residua in aria di principio attivo è ulteriormente diminuita. Applicando il medesimo principio, che stabilisce come l’esposizione per una singola applicazione deve tenere conto della concentrazione residua, al livello di esposizione calcolato al termine delle tre nuove applicazioni si aggiunge anche la quantità residua di principio attivo presente nella camera e dovuta alle precedenti applicazioni (Figura 3).
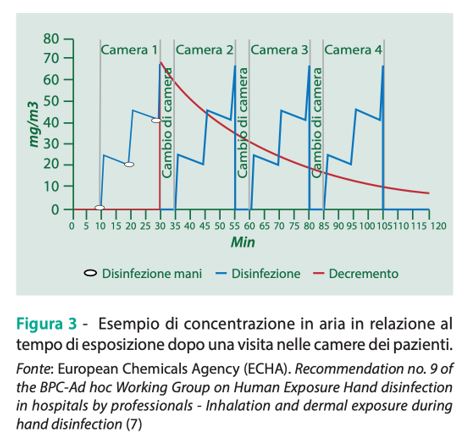
Poiché il modello ConsExpo è in grado di stimare solo l’esposizione associata alla prima applicazione, è stato elaborato un foglio di calcolo Excel attraverso il quale, esportando i dati stimati dal ConsExpo, è possibile calcolare: la concentrazione media dopo 3 applicazioni; la concentrazione residua in aria dopo 240 minuti; il valore limite di esposizione medio (il TWA (Time Weighted Average) – valore limite ponderato – rappresenta la concentrazione media, ponderata nel tempo, degli inquinanti presenti nell’aria degli ambienti di lavoro nell’arco dell’intero turno lavorativo e indica il livello di esposizione al quale si presume che il lavoratore possa essere esposto 8 ore al giorno, per 5 giorni alla settimana, per tutta la durata della vita lavorativa, senza risentire di effetti dannosi per la salute) (10).
Si sottolinea, infine, come i livelli attesi di esposizione, calcolati per i diversi intervalli temporali, sono strettamente correlati alle proprietà chimico-fisiche del principio attivo (ad esempio, la sua solubilità e tensione di vapore), alle dimensioni della camera e al tasso di ventilazione, parametri che influiscono sulla velocità di incremento e diminuzione della concentrazione in aria. Conclusioni La metodologia sviluppata per valutare l’esposizione associata all’uso dei prodotti per la disinfezione delle mani senza risciacquo prevede un’applicazione combinata del modello ConsExpo con una serie di algoritmi disponibili su un foglio Excel. La procedura, sviluppata nei documenti di orientamento concordati a livello europeo dal gruppo di esperti sull’esposizione umana per i biocidi, consente di stimare in modo affidabile e ragionevolmente cautelativo i livelli di esposizione attesi in intervalli di tempo definiti, così da poter essere confrontati nella caratterizzazione del rischio con i livelli di non effetto a breve e lungo termine. La definizione di un ben delineato scenario di esposizione e l’individuazione dei parametri che maggiormente impattano sull’esito finale della stima dell’esposizione (frequenza e durata) garantiscono un approccio armonizzato nella valutazione del rischio dei prodotti disinfettanti autorizzati a livello europeo nel contesto normativo del regolamento biocidi. Dichiarazione sui conflitti di interesse Gli autori dichiarano che non esiste alcun potenziale conflitto di interesse o alcuna relazione di natura finanziaria o personale con persone o con organizzazioni, che possano influenzare in modo inappropriato lo svolgimento e i risultati di questo lavoro.
Riferimenti bibliografici
1. Italia. Decreto del Presidente della Repubblica 6 ottobre 1998, n. 392. Regolamento recante norme per la semplificazione dei procedimenti di autorizzazione alla produzione ed all’immissione in commercio di presidi medicochirurgici, a norma dell’articolo 20, comma 8, della legge 15 marzo 1997, n. 59. Gazzetta Ufficiale – Serie Generale n. 266, 13 novembre 1998.
2. Ministero della Sanità. Provvedimento 5 febbraio 1999. Approvazione dei requisiti della domanda e relativa documentazione da presentare ai fini dell’autorizzazione all’immissione in commercio ed alla variazione di autorizzazioni già concesse per i presidi medicochirurgici. Gazzetta Ufficiale – Serie Generale n. 34, 11 febbraio 1999.
3. Regolamento (UE) n. 528/2012 del Parlamento europeo e del Consiglio, 22 maggio 2012, relativo alla messa a disposizione sul mercato e all’uso dei biocidi. Gazzetta ufficiale dell’Unione Europea L 167/1, 27 giugno 2012.
4. De Castro P, Rossi AM, Morini G (Ed.). Numero Speciale ISS per COVID-19. Not Ist Super Sanità 2020;33(3-4-5):3-51.
5. Attias L, Cresti R. La valutazione del rischio nella scelta dei prodotti chimici sanificanti. In: Govoni C, Gargano G, Ricci, R. (Ed). Atti del Convegno Nazionale – CLP-REACH 2020 Sanificanti nei luoghi di vita e di lavoro: Etichettatura, Scheda di Dati di Sicurezza, Notifica e Tecnologie. Bologna, 2 dicembre 2020. Modena: Azienda USL di Modena; 2020.
6. European Chemical Agency. Recommendation no. 1 of the BPC-Ad hoc Working Group on Human Exposure Hand disinfection – PT 1 harmonisation of exposure determinants for professional users. Helsinki, Finland: ECHA; 2014 (https://echa.europa.eu/it/view-article/-/journal_content/title/recommendations-of-the-ad-hoc-workinggroup-on-human-exposure).
7. European Chemical Agency. Recommendation no. 9 of the BPC-Ad hoc Working Group on Human Exposure Hand disinfection in hospitals by professionals – Inhalation and dermal exposure during hand disinfection. Helsinki, Finland: ECHA; 2016 (https://echa.europa.eu/it/view-article/-/journal_content/title/recommendations-of-the-adhoc-working-group-on-human-exposure).
8. Rijksinstituut voor Volksgezondheid en Milieu (RIVM). Prud’homme de Lodder LCH, Bremmer HJ, Pelgrom SMGJ, Park MVDZ, van Engelen JGM. Disinfectant products fact sheet to assess the risks for the consumer. RIVM report 320005003/200. Bilthoven, The Netherlands; 2006 (https://www.rivm.nl/bibliotheek/rapporten/320005003.pdf).
9. European Chemical Agency. HEEG opinion 3 – Use of ConsExpo for the Exposure Assessment for Professional Users. Helsinki, Finland: ECHA; 2008 (https://echa.europa. eu/it/view-article/-/journal_content/title/support-biocides-heeg-opinions).
10. European Chemical Agency. Annex – Inhalation exposure calculation ConsExpo. Helsinki, Finland: ECHA; 2016 (https://echa.europa.eu/it/view-article/-/journal_content/title/recommendations-of-the-ad-hoc-workinggroup-on-human-exposure).

